Le cycle de vie du Médicament RadioPharmaceutique : de la recherche à l’utilisation clinique
Les Médicaments RadioPharmaceutiques (MRP) ou radiopharmaceutiques sont des médicaments qui contiennent des radionucléides.
Ils sont utilisés majoritairement, d’une part, pour réaliser des procédures diagnostiques ou des évaluations de traitements par imagerie : le rayonnement détecté via des caméras de Médecine Nucléaire aide à observer et analyser le fonctionnement du corps humain.
D’autre part, ils servent pour des traitements thérapeutiques car le rayonnement émis est en mesure de s’attaquer précisément à des cellules cancéreuses ou malades. Bien que cela ne représente qu’environ 10% de l’utilisation des Médicaments RadioPharmaceutique à l’heure actuelle, cette pratique est en pleine expansion et se développe très rapidement.
Les MRP sont des radiotraceurs, ils sont habituellement constitués de deux éléments :
- le marqueur : un radioisotope qui délivre un rayonnement
- le vecteur : une molécule non-radioactive spécifique à l’organe ou au tissu de la cellule ciblée
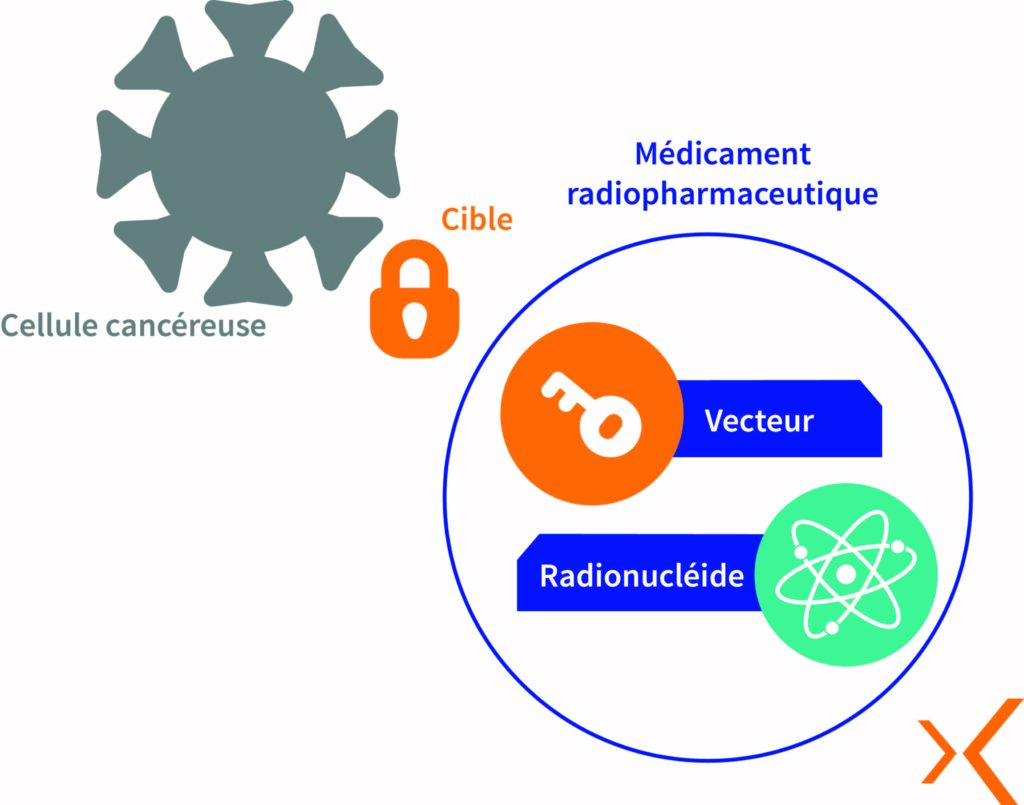
Au cœur des Médicaments RadioPharmaceutiques se trouvent les radioisotopes ou radionucléides. Ce sont des minuscules particules émettrices de radiations. Chaque radionucléide est minutieusement choisi en fonction de sa stabilité, de sa période radioactive et de ses caractéristiques d’émissions nécessaires aux applications médicales. Par la suite, ces radio-isotopes sont associés à des molécules sélectionnées en fonction de leurs propriétés biologiques, celles-ci vont conduire le radioisotope vers la cellule cible pour s’y accrocher.
De nouvelles combinaisons sont créées et dotées de propriétés spécifiques, selon la visée diagnostique ou thérapeutique et la zone précise du corps à atteindre pour émettre efficacement des rayonnements.
Leur cycle de vie, depuis la phase de recherche et développement jusqu’à leur utilisation clinique, est un processus complexe et crucial qui nécessite une étroite collaboration entre chercheurs, autorités, fabricants et professionnels de santé.
Innovation en laboratoire : la phase de Recherche et Développement (R&D)
Le cycle de vie d’un Médicament RadioPharmaceutique débute par la phase de Recherche et Développement (R&D). Cette étape implique la découverte et l’expérimentation de nouveaux composés, la recherche préclinique pour évaluer leur toxicité et leur efficacité, ainsi que les essais cliniques chez l’Homme pour déterminer leur utilité médicale.
L’objectif de ces expérimentations est d’étudier de nouvelles associations ou de nouvelles méthodes afin de trouver de nouvelles façons de rendre les diagnostics et les traitements plus performants et pour prendre en charge davantage de cancers.
Des essais précliniques et cliniques sont ensuite réalisés. Comme tout médicament, chaque radiopharmaceutique est soumis à des tests rigoureux. Ces évaluations confirment la pureté, la stabilité et la spécificité de la liaison.

Ces essais cliniques fournissent des connaissances précieuses sur les mécanismes des maladies cancéreuses mais aussi sur la réponse des patients à des thérapies innovantes. Cette phase agit comme un filtre, ne permettant qu’aux produits radiopharmaceutiques les plus efficaces et les plus fiables de passer à l’étape suivante.
Autorisation Réglementaire : obtention de l’Autorisation de la Mise sur le Marché (AMM)

Une fois les essais cliniques terminés et les données recueillies, le Médicament RadioPharmaceutique doit être soumis aux autorités réglementaires compétentes afin d’effectuer une évaluation rigoureuse de la sécurité, de l’efficacité et de la qualité du médicament. Ces demandes d’AMM sont déposées auprès de l’Agence Nationale de Sécurité du Médicament (ANSM) pour la France, mais également de l’Agence Européenne des Médicaments (EMA) au niveau européen ou encore de la Food and Drug Administration (FDA) aux États-Unis, par exemple.
Du fait de leur nature radioactive, les radiopharmaceutiques sont soumis à une double réglementation : celle des médicaments (notamment des substances potentiellement toxiques) et celle des radionucléides ou radioéléments. Cette double réglementation entraîne l’application de deux ensembles de lois, de règlements et de normes, ainsi que des exigences particulières à chaque étape de leur parcours.
Ces nouveaux médicaments doivent être conformes en matière de :
- Qualité : selon les normes pharmaceutiques et analytiques
- Sécurité : selon les normes toxicologiques et pharmacologiques
- Efficacité : selon les normes cliniques
Une fois approuvé, le Médicament RadioPharmaceutique entre dans la phase de production et de distribution
Les radiopharmaceutiques doivent respecter les conditions de production communes à tous les médicaments.
Ils présentent cependant des caractéristiques qui nécessitent des adaptations technologiques en raison de leur nature radioactive.
La principale particularité est la durée de vie des produits. En effet, chaque radionucléide contenu dans un MRP possède une demi-vie spécifique, c’est la période physique à laquelle se déroule sa décroissance radioactive (la radioactivité de cet isotope diminue de moitié). Cette demi-vie varie considérablement d’un isotope à l’autre. Par exemple, une demi-vie de quelques heures est idéale pour des applications en imagerie médicale, car elle permet des examens diagnostiques rapides avec une exposition limitée aux radiations. En revanche, pour des traitements thérapeutiques, on préfère souvent des isotopes ayant une demi-vie un peu plus longue afin d’assurer une action prolongée.
Les MRP possèdent en majorité une courte période radioactive ce qui conduit à :
- une fréquence de fabrication hebdomadaire ou journalière
- des lots de taille restreinte (de 10 à 10 000 unités)
- et une logistique de production et d’acheminement répondant aux besoins des services de Médecine Nucléaire.


Tout au long du processus de production, les Bonnes Pratiques de Fabrication (BPF), doivent être respectées afin de garantir la qualité de la production, de protéger les patients mais surtout d’assurer la sécurité des opérateurs conformément au principe ALARA*.
*ALARA : As low As reasonably Achievable, pouvant se traduire en français par « Aussi bas que raisonnablement possible » est l’un des principes de base de la protection contre les rayonnements ionisants.
Des contrôles de qualité sont mis en place pour garantir des performances optimales lors de l’utilisation en milieu clinique, avant toute administration au patient. De plus, des organismes réglementaires tels que l’ASN (Autorité de Sûreté Nucléaire) et l’IRSN (Institut de Radioprotection et de Sûreté Nucléaire) en France, adressent leurs recommandations.
Il existe deux modes de fabrication possibles selon la nature des produits : le MRP « prêt à l’emploi » et le MRP à préparer à l’aide de trousses et de générateurs.
Les MRP « prêts à l’emploi »
Les Médicaments RadioPharmaceutiques « prêts à l’emploi » sont produits au sein d’un établissement pharmaceutique. Ils sont ensuite acheminés vers les hôpitaux ou les centres d’examen. Ce sont majoritairement des médicaments multidoses, c’est-à-dire qu’un seul flacon va pouvoir être fractionné au sein du service de Médecine Nucléaire pour injecter plusieurs patients.
Les phases de fabrication des radiopharmaceutiques « Prêts à l’emploi »
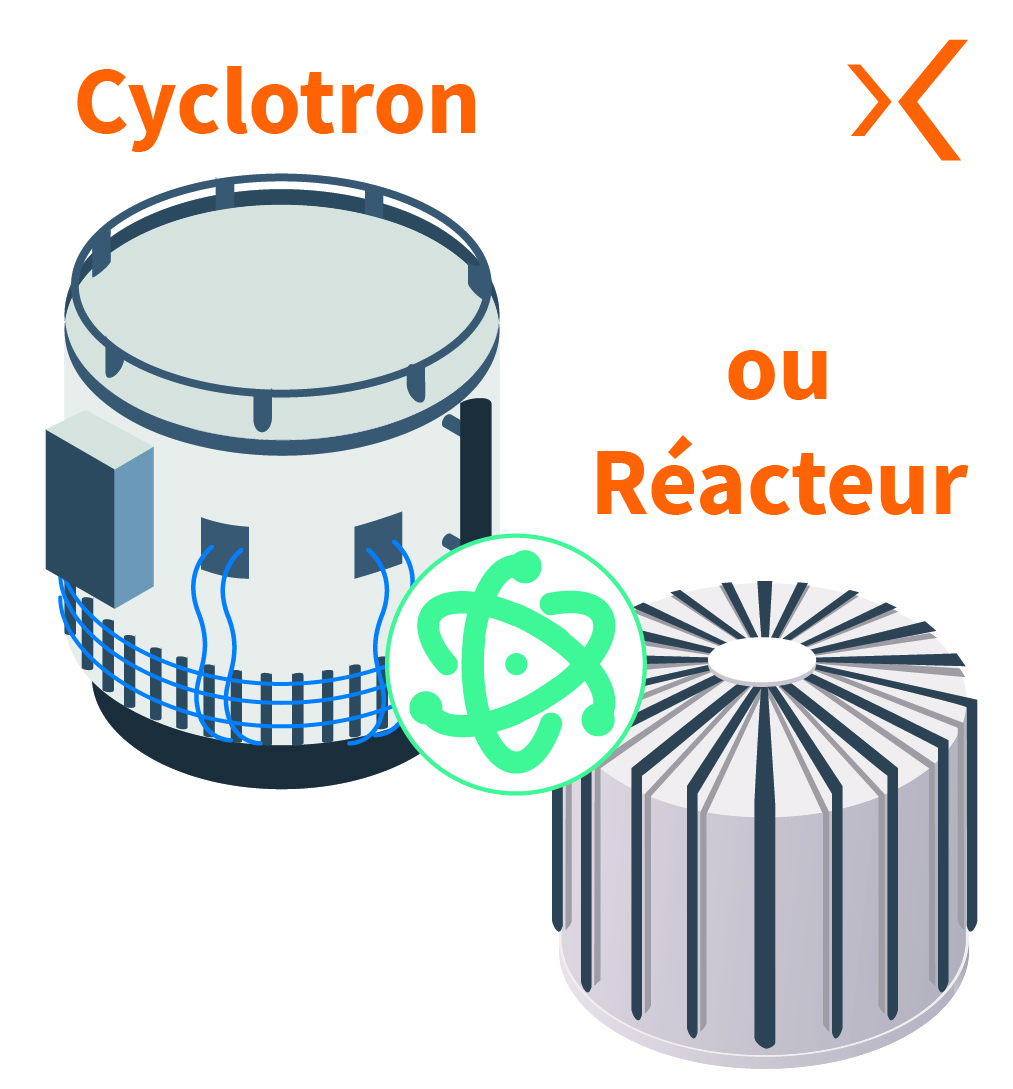
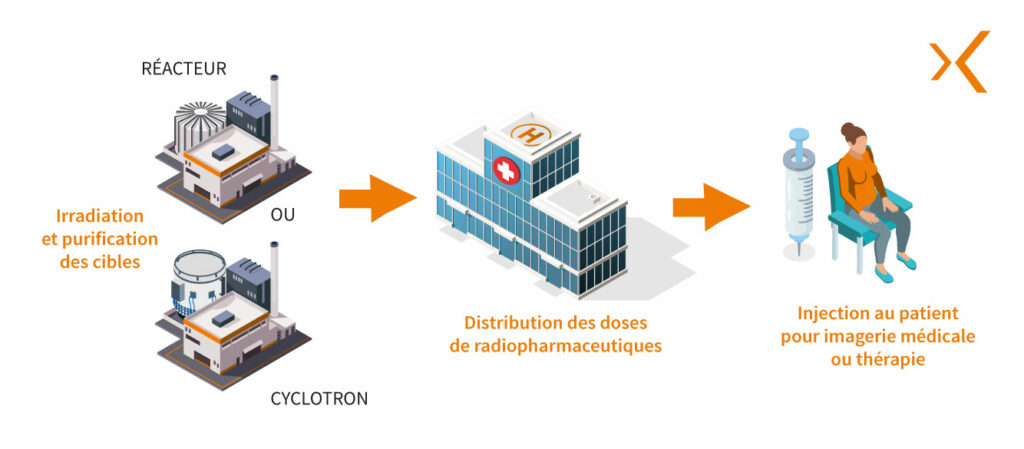
Tout d’abord, la production du radionucléide s’effectue en irradiant une cible spécifique à l’intérieur d’un réacteur de recherche ou d’accélérateurs de particules tels que des cyclotrons, pour créer une réaction nucléaire.
Ensuite, le radionucléide est purifié pour obtenir la forme chimique souhaitée, généralement sous forme de sel ou de complexe métallique. Cette étape est cruciale pour garantir la qualité et la pureté du radionucléide utilisé dans le médicament radiopharmaceutique.
La production du cyclotron est alors récupérée dans une enceinte blindée de production située dans un salle de préparation de MRP, un laboratoire chaud ou une salle blanche. C’est le lancement de la phase de radiosynthèse ou de radiomarquage de molécules d’intérêt à l’aide de modules de radiosynthèse : le radionucléide est combiné avec un vecteur spécifique pour former le radiopharmaceutique.
Cette production va être transférée dans les cellules blindées de répartition et de fractionnement, afin de réaliser des lots de produits radiopharmaceutiques à destination des services de Médecine Nucléaire.
A l’aide d’un appareil de distribution et d’une station de dosage, plusieurs opérations vont être amorcées pour finaliser les lots de MRP dont :
- L’étiquetage des lots
- La caractérisation de l’activité volumique
- Les dilutions nécessaires
- La préparation des flacons (dispensation, sertissage des flacons, transfert vers des protections plombées ou protèges-flacons plombés)


Les MRP à reconstituer à l’aide d’une trousse « froide »
Le Médicament RadioPharmaceutique à reconstituer est fabriqué au sein de l’unité de radiopharmacie de l’hôpital dans des enceintes blindées de préparation de radiopharmaceutiques. Chaque dose est préparée en fonction des besoins du patient.
La constitution manuelle du radiopharmaceutique
Les trousses pour préparation radiopharmaceutique contiennent une molécule vectrice destinée à être marquée mais qui ne renferme pas d’élément radioactif. Pour produire le radiopharmaceutique final, il faudra réaliser le marquage au sein d’une enceinte blindée à l’aide d’un générateur d’élément radioactif.
Les générateurs isotopiques contiennent le radionucléide « parent » choisi qui sert à la production d’un radionucléide de filiation obtenu notamment par élution.
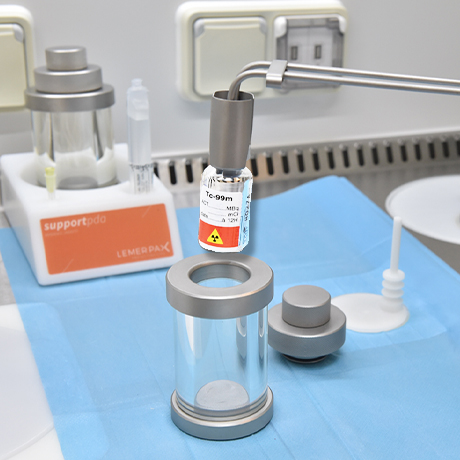
Ce procédé est utilisé notamment pour des isotopes ayant une demi-vie très courte. C’est le cas du technétium-99m – principal radioisotope utilisé pour les radiodiagnostics en basse et moyenne énergie – qui dispose d’une demi-vie de 6 heures, il est produit à partir d’une source de molybdène-99.
Autre exemple en haute énergie, le gallium-68 (demi-vie de 68 minutes) qui est produit à partir de l’isotope parent germanium-68.
Il existe différents protocoles de marquage selon les radionucléides et/ou les différents organes et tissus à explorer.
La dose patient prête à injecter va ensuite être conditionnée dans un protège-seringue en attendant son administration.


Une fois le Médicament RadioPharmaceutique constitué, une véritable course contre la montre s’enclenche
De manière générale, le médicament radiomarqué doit être préparé quelques heures ou même minutes avant son usage si sa demi-vie est très courte, d’où l’importance de devoir disposer parfois d’un centre de production (cyclotron) au sein des hôpitaux ou du centre d’examen.
L’utilisation clinique des Médicaments RadioPharmaceutiques dans les services de Médecine Nucléaire
L’utilisation clinique marque l’aboutissement du cycle de vie du Médicament RadioPharmaceutique. Ces médicaments sont majoritairement administrés aux patients par injection dans le cadre de procédures diagnostiques ou thérapeutiques.
L’injection peut s’effectuer manuellement à l’aide de protège-seringues, ou bien plus généralement de façon assistée grâce à un préparateur-injecteur automatique blindé pour une radioprotection optimale.
Il existe également d’autres moyens d’administrer le MRP : par voie orale (comme pour les gélules d’iode-131) ou encore par inhalation (notamment marqué au 99mTc ou 133Xe).
En imagerie diagnostique, les radiopharmaceutiques sont souvent utilisés avec des techniques d’imagerie à l’aide de gamma-caméra telles que la Tomographie par Emission MonoPhotonique (TEMP/SPECT), ou la Tomographie par Emission de Positons (TEP), offrant une vision fonctionnelle inestimable afin de déceler des pathologies complexes comme les cancers.
En thérapie, les radiopharmaceutiques sont utilisés pour cibler et s’attaquer à des cellules cancéreuses ou à des tissus malades. Ils ouvrent également la voie à des thérapies ciblées (Radiothérapie Interne Vectorisée), qui permettent la réalisation de traitements plus précis et réduisent ainsi les effets secondaires associés aux traitements conventionnels comme les chimiothérapies.


Une surveillance continue des MRP avec la pharmacovigilance
La pharmacovigilance a pour objectif principal de surveiller les médicaments une fois qu’ils sont en exercice. Elle permet d’identifier les risques potentiels, de signaler les effets secondaires non anticipés, et d’apporter des modifications aux recommandations d’utilisation si nécessaire.
La pharmacovigilance garantit ainsi une utilisation sécurisée et efficace des radiopharmaceutiques, contribuant à améliorer la qualité des soins et à protéger la santé des patients.
Conclusion
Le cycle de vie du médicament radiopharmaceutique est un processus multifactoriel, chaque étape est critique et indispensable pour assurer la sécurité et l’efficacité de ces médicaments.
C’est également un processus d’innovation et d’amélioration continues. Les chercheurs explorent continuellement de nouveaux composés, affinent les techniques de synthèse et étudient de nouveaux radioisotopes aux propriétés encore plus intéressantes aux grands bénéfices des patients.
Cette quête incessante de l’excellence vise à étendre les capacités des produits radiopharmaceutiques, ouvrant ainsi de nouvelles frontières à l’imagerie médicale et à la thérapie.















