Ciclo de vida del radiofármaco: desde la investigación hasta el uso clínico
Los radiofármacos son medicamentos que contienen radionúclidos.
Se utilizan principalmente, por una parte, para realizar procedimientos diagnósticos o evaluaciones de tratamientos por imágenes: la radiación detectada a través de cámaras de medicina nuclear ayuda a observar y analizar el funcionamiento del cuerpo humano.
Por otra parte, sirven para tratamientos terapéuticos, ya que la radiación emitida es capaz de atacar con precisión células cancerosas o enfermas. Aunque esto representa solo un 10 % aproximadamente del uso de radiofármacos en la actualidad, esta práctica está en plena expansión y se desarrolla muy rápidamente.
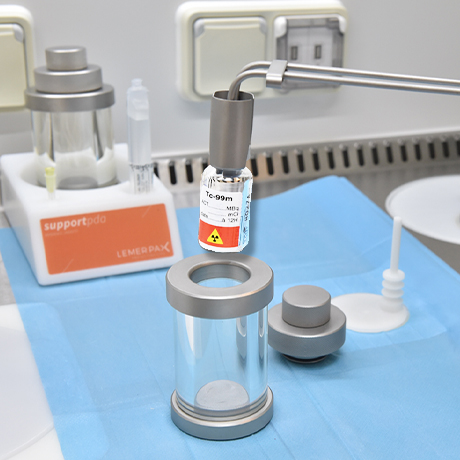
Los radiofármacos son radiotrazadores y suelen estar compuestos por dos elementos:
- el marcador: un radioisótopo que emite radiación
- el vector: una molécula no radiactiva específica del órgano o del tejido de la célula objetivo
En el epicentro de los radiofármacos se encuentran los radioisótopos o radionúclidos. Son partículas diminutas emisoras de radiaciones. Cada radionúclido se elige meticulosamente en función de su estabilidad, su periodo radiactivo y sus características de emisiones necesarias para las aplicaciones médicas. A continuación, estos radioisótopos se asocian con moléculas seleccionadas en función de sus propiedades biológicas; estas llevarán el radioisótopo hacia la célula objetivo para adherirse en ella.
Se crean nuevas combinaciones y se les dota de propiedades específicas, según el objetivo diagnóstico o terapéutico y la zona precisa del cuerpo que se ha de alcanzar para emitir radiaciones de manera eficaz.
Su ciclo de vida, desde la fase de investigación y desarrollo hasta su uso clínico, es un proceso complejo y crucial que requiere una estrecha colaboración entre investigadores, autoridades, fabricantes y profesionales de la salud.
Innovación en el laboratorio: fase de Investigación y Desarrollo (I+D)
El ciclo de vida de un radiofármaco comienza con la fase de Investigación y Desarrollo (I+D). Esta etapa implica el descubrimiento y la experimentación de nuevos compuestos, la investigación preclínica para evaluar su toxicidad y eficacia, así como los ensayos clínicos en humanos para determinar su utilidad médica.
El objetivo de estos experimentos es estudiar nuevas asociaciones o nuevos métodos para encontrar nuevas maneras de hacer que los diagnósticos y los tratamientos sean más eficaces, y para atender más tipos de cánceres. A continuación se realizan ensayos preclínicos y clínicos. Como todo medicamento, cada radiofármaco está sujeto a pruebas rigurosas. Estas evaluaciones confirman la pureza, la estabilidad y la especificidad de la unión.
Estos ensayos clínicos proporcionan valiosos conocimientos sobre los mecanismos de las enfermedades cancerosas, así como sobre la respuesta de los pacientes a tratamientos innovadores. Esta fase actúa como un filtro, permitiendo que solo los radiofármacos más eficaces y fiables pasen a la siguiente etapa.

Autorización reglamentaria: obtención de la autorización de comercialización

Una vez finalizados los ensayos clínicos y recopilados los datos, el radiofármaco debe presentarse a las autoridades normativas competentes para realizar una evaluación rigurosa de la seguridad, la eficacia y la calidad del medicamento. Estas solicitudes de autorización de comercialización se presentan, por ejemplo, a la Agence Nationale de Sécurité du Médicament (ANSM) para Francia, a la Agencia Europea de Medicamentos (EMA) a nivel europeo o a la Food and Drug Administration (FDA) en Estados Unidos.
Debido a su naturaleza radiactiva, los radiofármacos están sujetos a una doble normativa: la de los medicamentos (especialmente las sustancias potencialmente tóxicas) y la de los radionúclidos o radioelementos. Esta doble normativa conlleva la aplicación de dos conjuntos de leyes, reglamentos y normas, así como requisitos particulares en cada etapa de su recorrido.
Estos nuevos medicamentos deben estar conformes con los siguientes aspectos:
- Calidad: según las normas farmacéuticas y analíticas
- Seguridad: según las normas toxicológicas y farmacológicas
- Eficacia: según las normas clínicas
Una vez aprobado, el radiofármaco entra en la fase de producción y distribución
La principal característica es la vida útil de los productos. De hecho, cada radionúclido contenido en un radiofármaco tiene una vida media específica, es decir, el periodo físico en el cual se lleva a cabo su decaimiento radiactivo (la radiactividad de este isótopo se reduce a la mitad). Esta vida media varía considerablemente de un isótopo a otro, pudiendo ir de unos minutos a varios días, e incluso miles de años. Por ejemplo, una vida media de unas pocas horas es ideal para aplicaciones de imágenes médicas, ya que permite exámenes diagnósticos rápidos con una exposición limitada a las radiaciones.
Por otro lado, para tratamientos terapéuticos, se suelen preferir isótopos con una vida media más larga para asegurar una acción prolongada.
La mayoría de los radiofármacos tiene un periodo radiactivo corto lo que conduce a:
- una frecuencia de fabricación semanal o diaria
- lotes de tamaño reducido (de 10 a 10 000 unidades)
- y una logística de producción y transporte que satisfaga las necesidades de los servicios de medicina nuclear.


A lo largo del proceso de producción, las Buenas Prácticas de Fabricación (BPF) deben respetarse para garantizar la calidad de la producción, proteger a los pacientes y, sobre todo, garantizar la seguridad de los operadores conforme al principio ALARA*.
*ALARA: «As low As reasonably Achievable», que puede traducirse en español como «Tan bajo como sea razonablemente posible» es uno de los principios básicos de la protección contra las radiaciones ionizantes.
Se implementan controles de calidad para garantizar un rendimiento óptimo durante el uso en entornos clínicos, antes de cualquier administración al paciente. Además, organismos normativos como la ASN (Autorité de Sûreté Nucléaire) y el IRSN (Institut de Radioprotection et de Sûreté Nucléaire) emiten sus recomendaciones.
Existen dos modos de fabricación posibles según la naturaleza de los productos: el radiofármaco «listo para el uso» y el radiofármaco para preparar con kits y generadores
Radiofármacos «listos para el uso»
Los radiofármacos «listos para el uso» se producen en un establecimiento farmacéutico. A continuación se trasladan a los hospitales o los centros de examen. Son en su mayoría medicamentos multidosis, es decir, que un solo vial puede fraccionarse en el servicio de medicina nuclear para inyectar a varios pacientes.
Fases de fabricación de radiofármacos «listos para el uso»
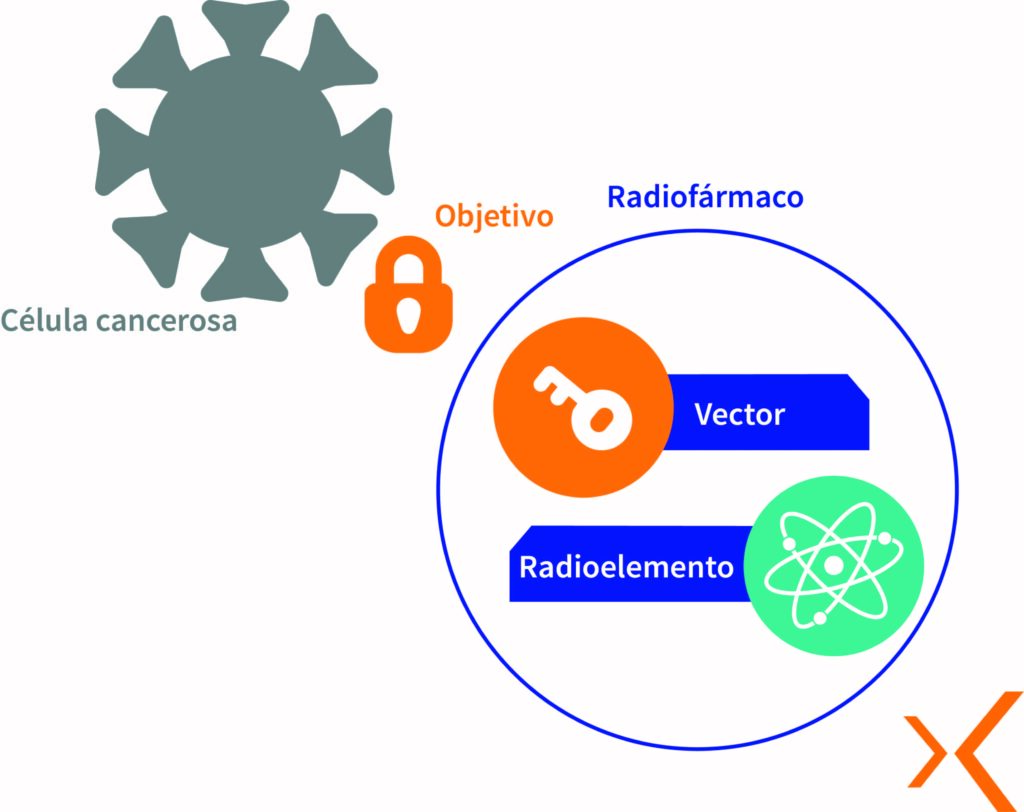
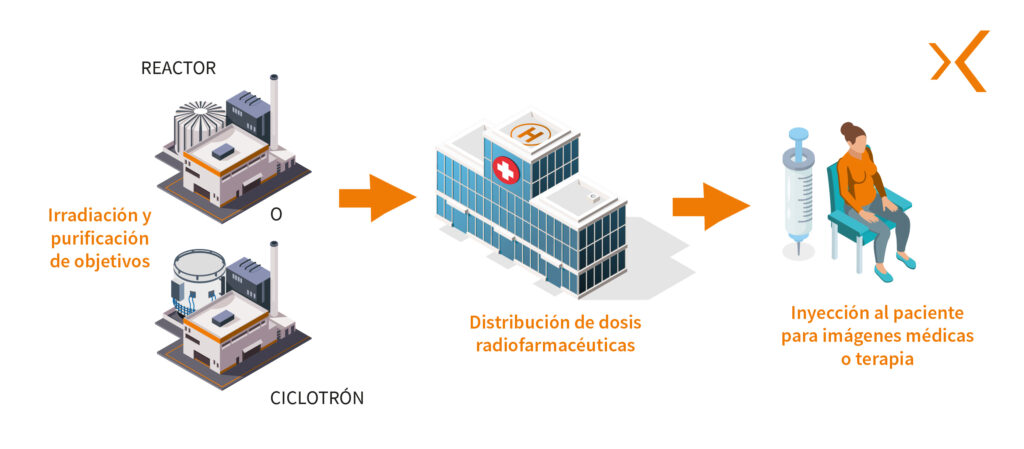
En primer lugar, la producción del radionúclido se lleva a cabo irradiando un objetivo específico dentro de un reactor de investigación o aceleradores de partículas como ciclotrones, para crear una reacción nuclear.
A continuación, el radionúclido se purifica para obtener la forma química deseada, generalmente en forma de sal o complejo metálico. Esta etapa es fundamental para garantizar la calidad y la pureza del radionúclido utilizado en el medicamento radiofarmacéutico.
Luego la producción del ciclotrón se recupera en una celda blindada de producción situada en una sala de preparación de radiofármaco, un laboratorio de radioisótopos o una sala blanca. Es el lanzamiento de la fase de radiosíntesis o de radiomarcado de moléculas de interés mediante módulos de radiosíntesis: el radionúclido se combina con un vector específico para formar el radiofármaco.
Esta producción se transferirá a las celdas blindadas de reparto y fraccionamiento, con el fin de realizar lotes de radiofármacos destinados a los servicios de medicina nuclear.
Con ayuda de un aparato de distribución y una estación de dosificación, se iniciarán varias operaciones para finalizar los lotes de radiofármacos, entre ellas:
- El etiquetado de los lotes
- La caracterización de la actividad volumétrica
- Las diluciones necesarias
- La preparación de los viales (dispensación, prensado de los viales, transferencia hacia protecciones plomadas o protectores de viales plomados)


Radiofármacos para reconstituir con un kit «frío»
El radiofármaco para reconstituir se fabrica en la unidad de radiofarmacia del hospital en celdas blindadas de preparación de radiofármacos. Cada dosis se prepara según las necesidades del paciente.
Constitución manual del radiofármaco
Los kits para preparación radiofarmacéutica contienen una molécula vectora destinada a ser marcada, pero que no contiene ningún elemento radiactivo. Para producir el radiofármaco final, será necesario realizar el marcado dentro de una celda blindada utilizando un generador de elemento radiactivo.
Los generadores isotópicos contienen el radionúclido «padre» elegido que sirve para producir un radionúclido de filiación obtenido, en particular, por elución.
Este proceso se utiliza especialmente para isótopos que tienen una vida media muy corta. Es el caso del tecnecio-99m, principal radioisótopo utilizado para los radiodiagnósticos en baja y media energía, que tiene una vida media de 6 horas y se produce a partir de una fuente de molibdeno-99.
Otro ejemplo en alta energía, el galio-68 (vida media de 68 minutos) que se produce a partir del isótopo padre germanio-68.
Existen diferentes protocolos de marcado según los radionúclidos y/o los diferentes órganos y tejidos a explorar. A continuación, la dosis para el paciente lista para inyectar se acondicionará en un protector de jeringa mientras espera su administración.


Una vez que se ha constituido el radiofármaco, comienza una auténtica carrera contrarreloj
De forma general, el medicamento radiomarcado debe prepararse unas horas o incluso minutos antes de su uso si su vida media es muy corta, de ahí la importancia de disponer a veces de un centro de producción (ciclotrón) en los hospitales o el centro de examen.
Uso clínico de radiofármacos en los servicios de medicina nuclear
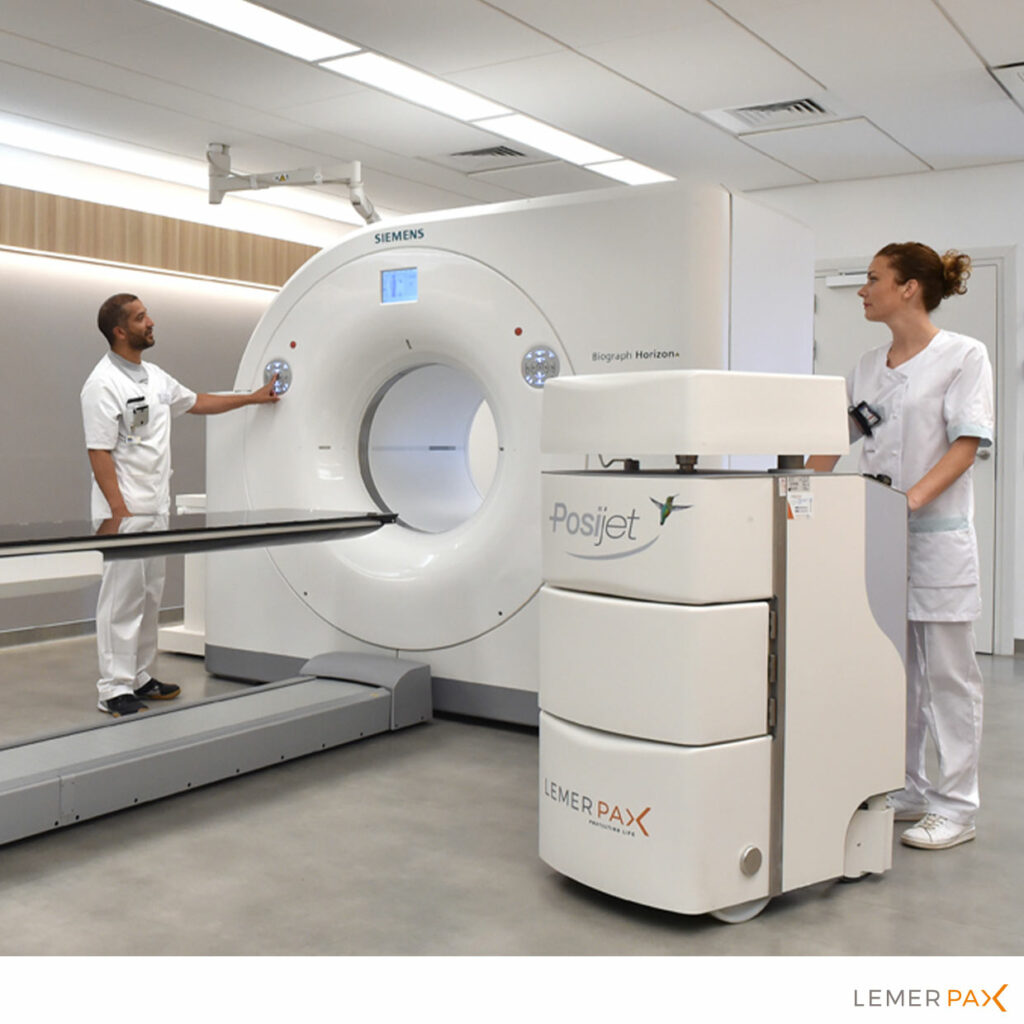
El uso clínico marca el fin del ciclo de vida del radiofármaco. Estos medicamentos se administran en su mayoría a los pacientes por inyección en el marco de procedimientos diagnósticos o terapéuticos. La inyección puede realizarse manualmente mediante protectores de jeringas, o más generalmente de forma asistida gracias a un preparador e inyector automático blindado para una radioprotección óptima.
Existen también otros medios para administrar el radiofármaco: por vía oral (como para las cápsulas de yodo-131) o también por inhalación (marcados en particular con 99mTc o 133Xe).
En el diagnóstico por imagen, los radiofármacos se suelen utilizar con técnicas de imagen con cámaras gamma como la Tomografía por Emisión de Fotón Único (TEMP/SPECT) o la Tomografía por Emisión de Positrones (TEP), ofreciendo una visión funcional muy valiosa para detectar patologías complejas como los cánceres.
En terapia, los radiofármacos se utilizan para dirigirse y atacar células cancerosas o tejidos enfermos. También allanan el camino a terapias dirigidas (radioterapia interna vectorizada), que permiten la realización de tratamientos más precisos reduciendo de este modo los efectos secundarios asociados a tratamientos convencionales como las quimioterapias.


Supervisión continua de los radiofármacos con la farmacovigilancia
La farmacovigilancia tiene como objetivo principal vigilar los medicamentos una vez que están en uso. Permite identificar los riesgos potenciales, señalar los efectos secundarios no anticipados y realizar modificaciones en las recomendaciones de uso si fuera necesario.
De este modo, la farmacovigilancia garantiza un uso seguro y eficaz de los radiofármacos, contribuyendo a mejorar la calidad de la atención y a proteger la salud de los pacientes.
Conclusión
El ciclo de vida del radiofármaco es un proceso multifactorial donde cada etapa es crítica e indispensable para garantizar la seguridad y la eficacia de estos fármacos.
Es también un proceso de innovación y mejora continuas. Los investigadores exploran continuamente nuevos compuestos, afinan las técnicas de síntesis y estudian nuevos radioisótopos con propiedades aún más interesantes en beneficio de los pacientes.
Esta búsqueda incesante de la excelencia tiene como objetivo aumentar las capacidades de los radiofármacos, abriendo así nuevas fronteras a las imágenes médicas y la terapia.